Prawo Hessa – Jak działa chemiczna magia entalpii?
Cześć chemiczni magicy! Czas na małą podróż w świat reakcji chemicznych, które zmieniają nie tylko substancje, ale i energię! A skoro energia jest zawsze tematem gorącym, to dzisiaj rzucimy okiem na Prawo Hessa – takie chemiczne „nie ma znaczenia, jak to robisz, ważne co wyjdzie na końcu!” Gotowi? To zaczynamy!
Czym jest Prawo Hessa i dlaczego warto go znać?
Do tej pory analizowaliśmy przykłady bardziej fizyczne, np. sprężaliśmy jakichś gaz albo rozprężaliśmy i zastanawialiśmy się jak to wpłynie na energię wewnętrzną albo entalpię reakcji. Czas pójść o krok dalej. Tym razem przeanalizujemy sytuację, w której w układzie zachodzi reakcja chemiczna i na skutek tej reakcji będzie zmieniała się energia wewnętrzna i entalpia. No dobra, zanim zaczniemy mieszać w chemicznych kociołkach, wyjaśnijmy sobie, co to za cudowne prawo. Prawo Hessa mówi, że ciepło reakcji (a dokładniej entalpia) w warunkach izobarycznych (ciśnienie stałe) i izochorycznych (objętość stała) zależy wyłącznie od stanu początkowego i końcowego, a nie od tego, ile karkołomnych reakcji po drodze zrobimy.
Tak, dobrze słyszysz! Możesz sobie iść na kawę w trakcie reakcji – o ile końcowy wynik się zgadza, nie ma problemu!
Ważne pojęcia – zanim zaczniemy mieszać w reaktorze
Aby swobodnie korzystać z Prawa Hessa, musisz poznać kilka kluczowych terminów. Oto one – zapamiętaj, zanim zaczniesz eksperymenty!
Standardowa entalpia tworzenia
To po prostu ilość energii, którą potrzebujesz, aby z pierwiastków stworzyć 1 mol produktu w temperaturze 298 K. Trochę jak gotowanie, tylko bez piekarnika i składników z Biedronki.
Standardowa entalpia spalania
Standardowa entalpia spalania: w wyniku tej reakcji spalamy 1 mol substancji
Jak Prawo Hessa rządzi światem reakcji?
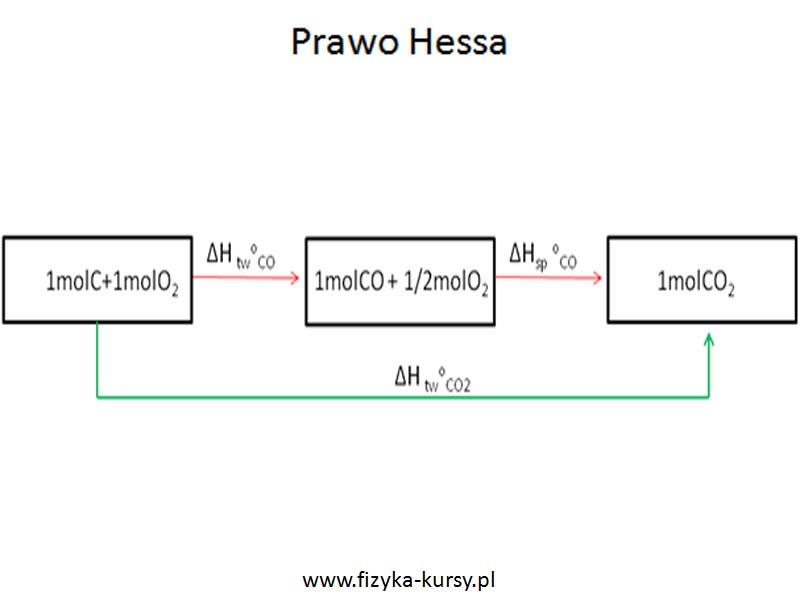
Prawo Hessa to król reakcji chemicznych, ponieważ mówi, że entalpia reakcji nie zależy od drogi przemiany. Możemy tworzyć dwutlenek węgla z prostych związków chemicznych, idąc drogą przez zielone strzałki (krótko i bezpiecznie) albo przez czerwone strzałki (z dodatkową wycieczką po górskich szczytach chemicznych), ale efekt zawsze będzie ten sam.
To tak jak w kuchni – czy gotujesz makaron zgodnie z przepisem, czy od serca, zawsze wyjdzie makaron
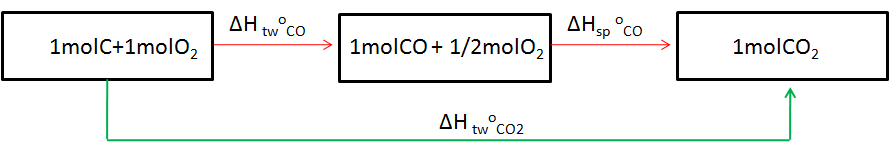
Korzystając z prawa Hessa i powyższego diagramu można napisać następujące reakcje:
ΔH twoCO2 = ΔH twoCO + ΔHsp oCO
ΔH twoCO = ΔH twoCO2 - ΔH twoCO
Dokładnie taki sam ciąg myślowy jest gdy zastosujemy wzór na zmianę entalpii reakcji chemicznej:
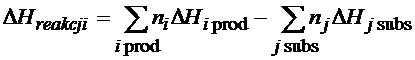
Zgodnie z powyższym równaniem wynika, że gdybyśmy np. chcieli obliczyć entalpię spalania tlenku węgla II to musielibyśmy od entalpii tworzenia dwutlenku węgla (bo to jest produkt spalania tlenku węgla II) odjąć entalpię tworzenia substratów, a substratem jest CO i O2 (reakcja poniżej).
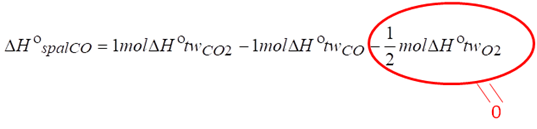
Warto się tutaj posłużyć przykładem, by dobrze zrozumieć o co chodzi w tym prawie. Rozważmy entalpię poniższej reakcji:
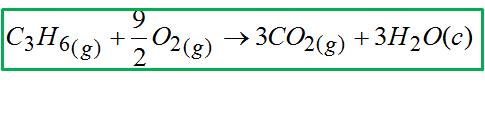
Zgodnie z prawem Hessa entalpię danej reakcji w określonej temperaturze można obliczyć znając entalpie innych reakcji (warunek jest jeden, że wartości tych entalpii są podane w tych samych temperaturach). Entalpia jest funkcją stanu, a to oznacza, że efekt energetyczny nie zależy od drogi. Skoro nie zależy od drogi to równie dobrze po drodze można przeprowadzić mnóstwo innych reakcji aż ostatecznie otrzyma się tę powyżej. Całkowity efekt energetyczny tych wszystkich reakcji po drodze da efekt energetyczny reakcji powyżej. Ostatecznie prawo Hessa sprowadza się do tego, że wystarczy znaleźć takie reakcje, które zawierają cząsteczki jak w tej głównej, w zielonej ramce. Krótko mówiąc, żeby obliczyć entalpię reakcji z zielonej ramki to trzeba znaleźć reakcję, w której będzie propen, tlen, dwutlenek węgla oraz woda. Ja wiem, że na razie brzmi to dosyć zawile, ale jak zrobimy jakichś przykład to wszystko się wyjaśni.
Ja sobie wybrałem 3 jakieś tam dowolne reakcje ( odczytałem je z tablic).
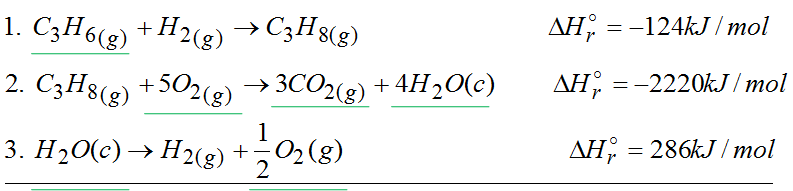
Pierwsza reakcja dostarcza nam propen. Druga reakcja dostarcza tlen, dwutlenek węgla i wodę. Oprócz tego przyda się również reakcja rozkładu wody. Na końcu tak przekształcimy te trzy reakcje, że otrzymamy reakcję taką jak w zielonej ramce. Następnie patrzymy czy wszystkie elementy są po poprawnej stronie reakcji.
W reakcji w zielonej ramce propen jest po lewej stronie i jest tam tylko 1 mol tej substancji. W zaproponowanych przeze mnie reakcjach propen również jest po lewej stronie równania oraz jest tam 1 mol. Tak więc z pierwszą reakcją nic nie robimy. Gdyby na przykład w pierwszej reakcji propen był po prawej stronie reakcji to z tego powodu trzeba by było obrócić reakcję a entalpie wymnożyć przez -1.
Ta druga reakcja wnosi 3 mole CO2 dokładnie tyle samo co w reakcji z zielonej ramki. Na razie nie patrzę na tę ostatnią reakcję. Ją użyjemy na samym końcu.
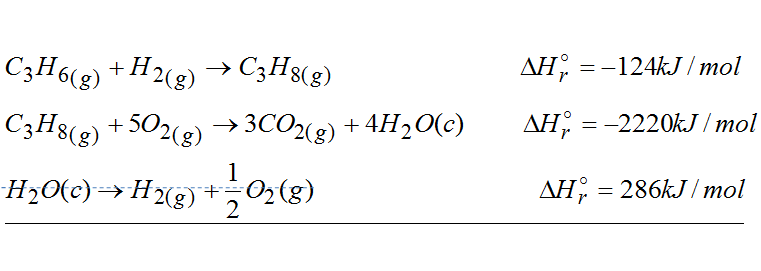
Teraz zsumujemy pierwszą i drugą reakcję. To sumowanie polega na tym, że dodajemy do siebie wszystko to co mamy po lewych stronach reakcji i osobno to co mamy po prawych stronach reakcji.
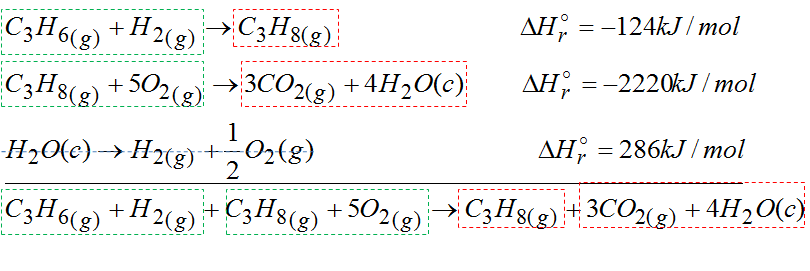
Następnie patrzymy czy nie da się czegoś skrócić:
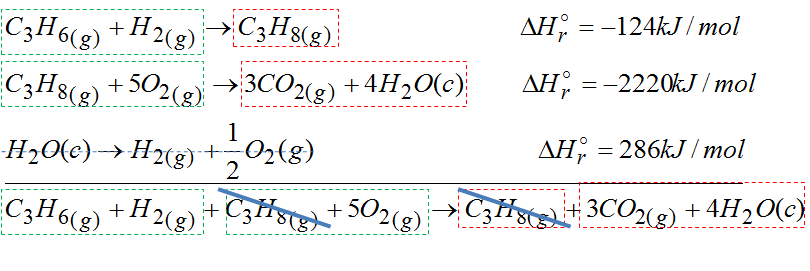
Po skróceniu otrzymaliśmy reakcję, która jest bardzo podobna do tej pierwszej z zielonej ramki. Problem w tym, że po lewej stornie nie powinno być wodoru, tlenu też jest nie odpowiednia ilość. Wody powinno być 3 mole, a tutaj nam wychodzi że są 4 mole. Z tego powodu trzeba uruchomić reakcję z wodą. Jak ją dodamy to finalnie otrzymamy dokładnie to co mieliśmy na samym początku w zielonej ramce.
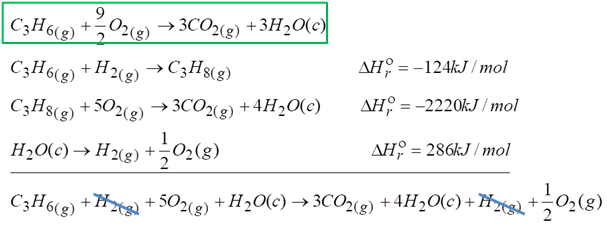
Po skróceniu otrzymałem dokładnie tę samą reakcję co z zielonej ramki.
Zakończenie – Z Prawem Hessa życie jest prostsze!
Prawo Hessa sprawia, że chemia przestaje być skomplikowana! Możesz iść z krótką, prostą ścieżką albo zrobić wielki chemiczny objazd – zawsze dojdziesz do tego samego wyniku. Także bez stresu, po prostu baw się entalpiami i ciesz się wynikami!
Jeśli chcesz więcej takich chemicznych sztuczek, wpadnij na mój kurs z chemii fizycznej 1b tam rozkładamy entalpię na czynniki pierwsze, ale z humorem!