Iloczyn rozpuszczalności – ZADANIA, które rozwiążesz z uśmiechem!
Wprowadzenie do iloczynu rozpuszczalności – szybka przypominajka
Czy kiedykolwiek zastanawiałeś się, co ma wspólnego Twoja herbata z chemią? Otóż całkiem sporo! Kiedy dodajesz cukier do gorącej wody, dochodzi do rozpuszczania, a w tle chemia działa na pełnych obrotach. Jednym z tych magicznych procesów jest właśnie iloczyn rozpuszczalności! O tym, co to dokładnie jest, mówiłem już w artykule, który znajdziesz TUTAJ. Jeśli jednak chcesz sobie przypomnieć lub rozwinąć temat, gorąco zapraszam do lektury.
Czas na zadania z iloczynu rozpuszczalności – przygotuj mózg na wyzwania!
A teraz, drogi czytelniku, zapnij pasy! Bo nadszedł czas, aby przejść do sedna i poćwiczyć iloczyn rozpuszczalności w praktyce. Przecież sama teoria bez praktyki to jak pizza bez sera – niby coś jest, ale czegoś brakuje!
Zadania są proste jak budowa cepa... no, prawie! Przygotowałem dla Ciebie cztery zadania, które pozwolą Ci nie tylko zrozumieć ten temat, ale może nawet odkryć w sobie miłość do chemii (tak, wiem, brzmi to niewiarygodnie). Ale pamiętaj – to tylko rozgrzewka. W moim kursie wideo czeka na Ciebie cała masa kolejnych zadań, a ja tam wszystko tłumaczę prostym i zrozumiałym językiem. Sprawdź kurs tutaj, zanim rozpuszczalność stanie się Twoim nowym hobby!
1. Oblicz iloczyn rozpuszczalności w temp. 25oC dla chlorku ołowiu II (PbCl2) jeśli wiesz, że w 1 litrze tego roztworu tej temperatury rozpuszcza się maksymalnie 11g tej soli.
Najpierw trzeba napisać reakcję dysocjacji soli z jaką masz do czynienia w danym zadaniu. W tym zadaniu pracujemy z chlorkiem ołowiu II.
PbCl2-->Pb2++2Cl-
Następnie trzeba napisać równanie na iloczyn rozpuszczalności dla danej reakcji. Zanim jednak to zrobisz to koniecznie pamiętaj o tym, aby uzupełnić współczynniki w reakcji. Jeśli tego nie zrobisz to źle obliczysz iloczyn rozpuszczalności! Po prostu, współczynniki stechiometryczne są potęgami w iloczynie rozpuszczalności. Iloczyn rozpuszczalności można oznaczyć jako Ir albo Kso. Pamiętaj, że w równaniu na iloczyn rozpuszczalności mogą się znaleźć tylko stężenia jonów. Stężenie soli w tym równaniu zupełnie pomijamy.
Ir=[ Pb2+]*[ Cl-]2
Równanie już mamy! Żeby obliczyć Ir to musimy obliczyć stężenie jonów Pb2+ oraz Cl-. Jak już się to uda to następnie wstawimy wartości tych stężeń do równania powyżej i dokończymy obliczenia. To do dzieła!
W treści zadania mamy podaną ilość gramów soli oraz objętość. To są wystarczające informacje do tego, żeby obliczyć stężenie PbCl2. Z reakcji dysocjacji widać, że z 1 mola chlorku ołowiu powstaje 1 mol kationów ołowiu, a więc ich ilości są takie same. Skoro ich ilości są takie same to ich stężenia również. Z tej samej reakcji widać, że z jednego mola PbCl2 powstają 2 mole Cl- czyli jonów chlorkowych jest 2x więcej niż soli. Jeśli jonów chlorkowych jest 2x więcej niż PbCl2 to znaczy, że również stężenie jonów chlorkowych będzie 2x większe niż soli. Skoro tak to przez R oznaczmy stężenie soli, a z tego wynika, że również ołów będzie mieć takie same stężenie, natomiast stężenie jonów chlorkowych jest równe 2R.
PbCl2-->Pb2++2Cl-
R R 2R
W takim razie możemy zmodyfikować Ir i wpisać to co ustaliliśmy.
Ir=R*[2R]2
Teraz wystarczy że obliczymy R czyli stężenie soli PbCl2 i wstawimy tę wartość do wzoru powyżej.
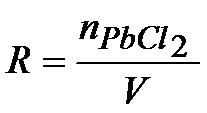
Musimy teraz obliczyć liczbę moli chlorku ołowiu. Z tym nie będzie problemu, bo z treści zadania znamy masę, a z układu okresowego możemy odczytać masę molową, która jest równa MPbCl2=278.2 g/mol. Musimy skorzystać z poniższego wzoru i przeliczyć to na liczbę moli.
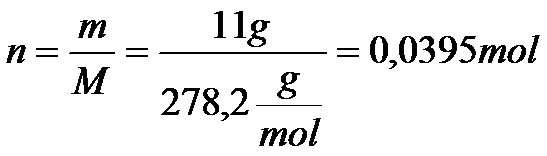
Stężenie chlorku ołowiu (PbCl2) jest równe:
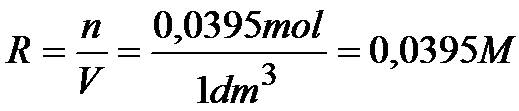
Mając już stężenie soli możemy wrócić do iloczynu rozpuszczalności i dokończyć jego obliczenie:
Ir=0,0395*[2*0,0395]2=2,47*10-4
2. Iloczyn rozpuszczalności siarczanu ołowiu jest równy 2,2*10-8. Na tej podstawie oblicz stężenie molowe siarczanu ołowiu w roztworze nasyconym.
Tak jak poprzednio, zacznijmy najpierw od reakcji dysocjacji (tak swoją drogą w chemii zawsze należy rozpoczynać zadania od reakcji jeśli takowa zachodzi w zadaniu).
PbSO4 --> Pb2++ SO42-
Przez R oznaczmy stężenie soli, a z reakcji widać, że w takim razie mamy dokładnie takie same stężenie ołowiu oraz jonów siarczanowych.
PbSO4 --> Pb2++ SO42-
R R R
Ir=[ Pb2+]*[ SO42-]
Wstawmy do iloczynu rozpuszczalności to co ustaliliśmy.
Ir=R*R
Musimy obliczyć ile jest równe R, bo to jest równe stężeniu soli , a to właśnie w tym zadaniu mamy obliczyć
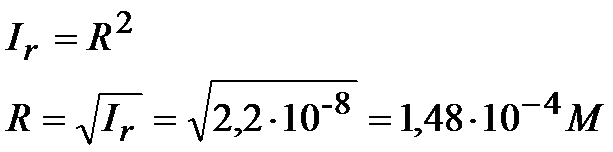
3. Oblicz czy wytrąci się osad, jeśli zmieszasz ze sobą 100cm3 azotanu srebra AgNO3 o stężeniu 10-5mol/dm3 z 50cm3 HCl o stężeniu 3*10-5mol przyjmij, że iloczyn rozpuszczalności chlorku srebra jest równy 1,1*10-10 .
Mieszamy ze sobą roztwory i zachodzi między nimi reakcja, więc oczywiście trzeba napisać równanie tej rekcji.
AgNO3+ HCl -->AgCl+HNO3
W tej reakcji może powstać trudno rozpuszczalny chlorek srebra. Dlaczego napisałem, że może powstać, a nie że powstanie? A no dlatego, że nie wiemy czy zostanie przekroczony iloczyn rozpuszczalności dla tego związku, po zmieszaniu ze sobą roztworów opisanych w treści zadania. Jeśli nie zostanie przekroczony iloczyn rozpuszczalności to nie wytrąci się osad. Po prostu wytworzy się zbyt mała ilość AgCl i wówczas tak mała ilość się rozpuści w roztworze (nie wytrąci się jeszcze osad). Nie mniej jednak jak mamy to zadanie rozważyć to musimy napisać reakcję dysocjacji dla związku trudno rozpuszczalnego (tak się robi zawsze).
Poniżej reakcja dysocjacji dla AgCl
AgCl < -- > Ag+ + Cl-
Następnie jak już napisaliśmy reakcję dysocjacji dla substancji trudno rozpuszczalnej to następnie trzeba napisać iloczyn rozpuszczalności dla tego związku. Zapamiętaj, że w iloczynie rozpuszczalności trzeba wymnożyć stężenia jonów.
Ir=[ Ag+]*[ Cl-]
Jeśli wymnożymy stężenia tych jonów to otrzymamy iloczyn tych stężeń. Jeśli ten iloczyn będzie mniejszy od wartości iloczynu rozpuszczalności, który znamy z treści zadania to osad się nie wytrąci. Jeśli natomiast iloczyn tych stężeń będzie większy to osad się wytrąci. Tak więc od tego momentu już wiadomo jakie jest dalsze postępowanie w tym zadaniu. Musimy obliczyć stężenia jonów srebra i jonów chlorkowych w roztworze, po zmieszaniu, a następnie trzeba je wymnożyć ze sobą i porównać wartości z tą, która się znajduje w treści zadania.
Stężenie jonów srebra po zmieszaniu obliczymy korzystając ze wzoru na stężenie molowe:
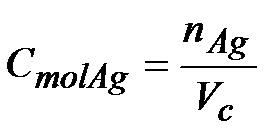
Na pewno trzeba dodać do siebie objętości obu roztworów, które ze sobą mieszamy.
Vc=100cm3+50cm3=150 cm3 àVc=0,15dm3
Stężenie molowe podajemy w mol/dm3, dlatego objętość też podałem w dm3
Teraz musimy obliczyć liczbę moli jonów srebra, ale z tym nie będzie problemu, bo wiemy ile azotanu srebra dodajemy do układu. Znamy również stężenie molowe tego roztworu:
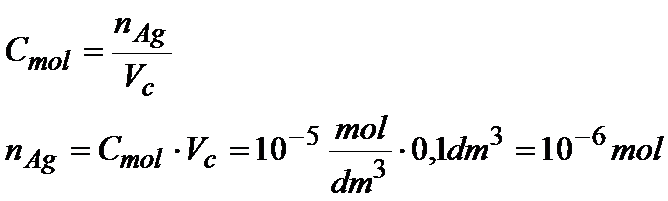
Musiałem wymnożyć stężenie molowe razy objętość i otrzymałem ilość moli
Znając już objętość i ilość moli możemy obliczyć stężenie jonów srebra.
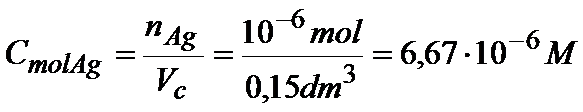
Ok. Stężenie molowe jonów srebra już mamy, to teraz musimy jeszcze obliczyć stężenie molowe jonów chlorkowych. Zrobimy to dokładnie tak samo.
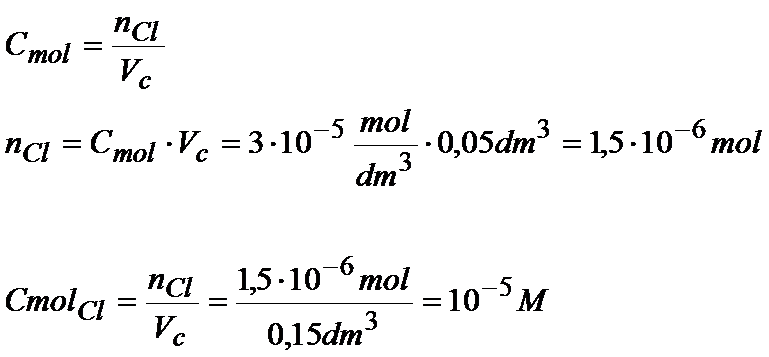
Mając już stężenia molowe jonów możemy dokończyć obliczenie iloczynu tych stężeń
Ir=6,67*10-6*10-5=6,67*10-11
Teraz możemy już porównać iloczyny (ten co właśnie obliczyliśmy oraz ten z treści zadania)
6,67*10-11<1,1*10-10 z tego wynika, że nasz iloczyn jest mniejszy niż iloczyn rozpuszczalności a to oznacza, że w tym przypadku osad się nie wytrąci.
4. Znając iloczyn rozpuszczalności arsenianu V magnezu 2*10-20 oblicz masę jonów znajdujące się w 200cm3 roztworu nasyconego.
Zaczynamy od reakcji dysocjacji
Mg3(AsO4)2 < -- > 3Mg2+ + 2AsO43-
Stężenie molowe rozpuszczonej soli oznaczmy jako „R”. Z reakcji widać, że 3x większe stężenie mają jony magnezu natomiast 2x większe jony arsenianowe. Poniżej zamieściłem te oznaczenia
Mg3(AsO4)2 < -- > 3Mg2+ + 2AsO43-
R 3R 2R
Teraz musimy napisać wzór na iloczyn rozpuszczalności dla reakcji powyżej i wstawić oznaczenia.
Ir=[ Mg2+]3*[ AsO43-]2
Ir=(3R)3*(2R)2=108R5
2*10-20=108R5
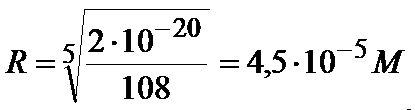
Teraz możemy obliczyć stężenia jonów:
[ Mg2+]=3*R=3*4,5*10-5=1,35*10-4M
[ AsO43-]=2*R=2*4,5*10-5M=9*10-5M
Znając już stężenia i objętość to możemy przelicz to na ilość moli:
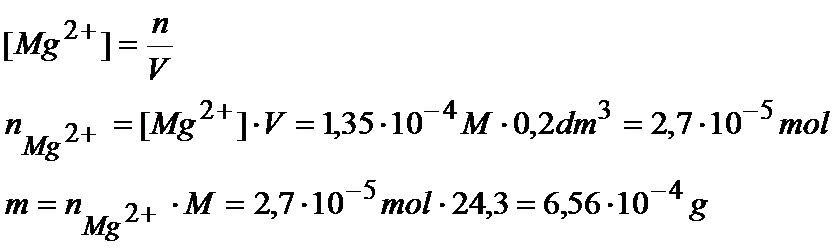
Teraz musimy obliczyć masę jonów arsenianowych:
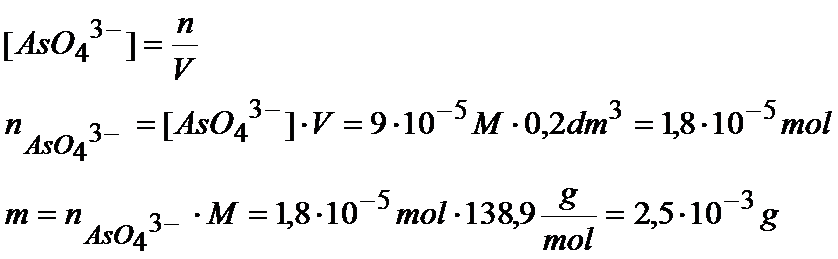
Więcej zadań? Sprawdź kurs wideo i poczuj chemię!
Jeśli po tych czterech zadaniach czujesz, że chemia przestała być taka straszna, to świetnie! Ale pamiętaj, że to dopiero początek. W kursie wideo znajdziesz mnóstwo podobnych zadań, a oprócz tego szczegółowe wyjaśnienia krok po kroku. Po tym kursie iloczyn rozpuszczalności nie będzie miał przed Tobą żadnych tajemnic. Kliknij TUTAJ i ruszaj do nauki!




